Teoría de los átomos
viernes, 24 de junio de 2016
jueves, 28 de abril de 2016
El HOMBRE QUE PESO LOS
ATOMOS DALTON
John Dalton fue el primer científico capaz de
pesar los átomos otorgándoles una característica cuantificable: su masa
relativa. Hasta finales del siglo XVIII se creía que los elementos químicos
estaban compuestos por átomos elementales iguales que se mantenían unidos
mediante fuerzas de afinidad mutua. Pero Dalton propone que los átomos de los
distintos elementos difieren entre sí en su masa, y publica la primera tabla de
pesos atómicos relativos conocida.
Pero sus contribuciones fundamentales al progreso de la ciencia tienen un alcance mucho más amplio. Es el responsable de la primera descripción científica completa de la ceguera al color (daltonismo), de grandes avances en la física de los gases, y de una elevada cantidad de trabajos meteorológicos –su vocación
Pero sus contribuciones fundamentales al progreso de la ciencia tienen un alcance mucho más amplio. Es el responsable de la primera descripción científica completa de la ceguera al color (daltonismo), de grandes avances en la física de los gases, y de una elevada cantidad de trabajos meteorológicos –su vocación
Conocemos ya que cualquier átomo (excepto el protio) está formado
principalmente por tres partículas sub-atómicas: protones, electrones y
neutrones. Ahora toca saber cómo estas partículas están distribuidas dentro del
átomo, lo que es mejor conocido como estructura atómica. La esfera atómica la
podemos dividir en dos zonas o regiones: el núcleo (esfera
interior) y la corteza (esfera exterior).
Regiones del átomo

El núcleo atómico
Los protones y neutrones de un átomo se encuentran ligados en el núcleo
atómico, la parte central del mismo. El volumen del núcleo es aproximadamente
proporcional al número total de nucleones, el número másico A, lo
cual es mucho menor que el tamaño del átomo, cuyo radio es
del orden de 105 fm o 1 ångström (Å). Los nucleones se mantienen unidos
mediante la fuerza nuclear, que es mucho más intensa que la fuerza
electromagnética a distancias cortas, lo cual permite vencer la repulsión
eléctrica entre los protones. Los átomos de un mismo elemento tienen el mismo
número de protones, que se denomina número atómico y se representa por Z.
o.
·
Partículas subatómicas:
A pesar de que átomo significa
"indivisible", en realidad está formado por varias partículas
subatómicas. El átomo contiene protones, neutrones y electrones, con la
excepción del hidrógeno-1,
que no contiene neutrones, y del catión hidrógeno o hadrón, que no contiene
electrones. Los protones y neutrones del átomo se a +2/3 y -1/3
respectivamente, respecto de la carga elemental. Un protón contiene dos quarks u y
un quark d, mientras que el neutrón contiene dos d y
un u, en consonancia con la carga de ambos. Los quarks se mantienen
unidos mediante la fuerza nuclear fuerte, mediada por gluones —del mismo modo
que la fuerza
.

Nube de electrones
Los electrones en el átomo son atraídos por los protones a través de la
fuerza electromagnética. Esta fuerza los atrapa en un pozo de potencial
electrostático alrededor del núcleo, lo que hace necesaria una fuente de
energía externa para liberarlos. Cuanto más cerca está un electrón del núcleo,
mayor es la fuerza atractiva, y mayor por tanto la energía necesaria para que
escape.
Los electrones, como otras partículas, presentan simultáneamente
propiedades de partícula puntual y de onda, y tienden a formar un cierto tipo
de onda estacionaria alrededor del núcleo, en reposo respecto de este. Cada una
de estas ondas está
caracterizada por un orbital atómico, una función matemática que
describe

|
modelos atómicos
|
|
|
|
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
BIBLIOGRAFIA
Título
del libro: El hombre que
peso los átomos Dalton
NOMBRE
DEL AUTOR: Inés Pellón González
EDITORIAL: S.L.NIVOLA libro y ediciones
LENGUA:
Castellano
No.
DE EDICCION:
978884955997228
No.
DE PAGINAS: 158 pág.
domingo, 13 de marzo de 2016
Modelos atomicos.
Modelo atómico de John Dalton:
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas.
* La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
* Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
* Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
* Los átomos, al combinarse para formar compuestos guardan relaciones simples.
* Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
* Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Modelo atómico de Thomson:
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thompson donde las "pasas" (electrones) se situaban en la parte exterior del "pastel" (la carga positiva).
Detalles del modelo atómico:
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.


Modelo atómico de Rutherford:
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
* Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
* No explicaba los espectros atómicos.


Modelo atómico de Bohr:
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
“El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas.” Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
* Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
* Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
* Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no puede explicar la existencia de órbitas estables y para la condición de cuantización.


Modelo atómico de Schrödinger
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Teoría atómica
En física y química, la teoría atómica es una teoría de la naturaleza de la materia, que afirma que está compuesta por pequeñas partículas llamadas átomos.
La teoría atómica comenzó hace miles de años como un concepto filosófico, y fue en el siglo XIX cuando logró una extensa aceptación científica gracias a los descubrimientos en el campo de la estequiometría. Los químicos de la época creían que las unidades básicas de los elementos también eran las partículas fundamentales de la naturaleza y las llamaron átomos (de la palabra griega atomos, que significa "indivisible"

 . Sin embargo, a finales de aquel siglo, y mediante diversos experimentos con el electromagnetismo y la radiactividad, los físicos descubrieron que el denominado "átomo indivisible" era realmente un conglomerado de diversas partículas subatómicas (principalmente electrones, protones y neutrones), que pueden existir de manera separada. De hecho, en ciertos ambientes, como en las estrellas de neutrones, la temperatura extrema y la elevada presión impide a los átomos existir como tales. El campo de la ciencia que estudia las partículas fundamentales de la materia se denomina física de partículas.
. Sin embargo, a finales de aquel siglo, y mediante diversos experimentos con el electromagnetismo y la radiactividad, los físicos descubrieron que el denominado "átomo indivisible" era realmente un conglomerado de diversas partículas subatómicas (principalmente electrones, protones y neutrones), que pueden existir de manera separada. De hecho, en ciertos ambientes, como en las estrellas de neutrones, la temperatura extrema y la elevada presión impide a los átomos existir como tales. El campo de la ciencia que estudia las partículas fundamentales de la materia se denomina física de partículas. Electrones:
El electrón representado por el símbolo: e−, es una partícula subatómica de tipo fermiónico. En un átomo los electrones rodean el núcleo, compuesto únicamente de protones y neutrones.
Los electrones tienen una masa pequeña respecto al protón, y su movimiento genera corriente eléctrica en la mayoría de los metales. Estas partículas desempeñan un papel primordial en la química ya que definen las atracciones con otros átomos. Es una de las particulas subatomicas mas importantes. Tiene una masa 1835 veces menor al proton. El numero de lectroens tiene que ver con el numero de protones que haya en el nucleo atomico, es decir, si en el nucleo hay 5 protones, va a haber girando orbitalmente en el nucleo 5 electrones. En el modelo croe que el de Rutherford, se decia que el electron chocaba con el nucleo al perder energia, de ser asi lso atomos no existirian y todo lo que conocemos no existiria. (incluyendo barnie el dinosaurio)
Se los puede encontrar como dos ejemplos (aunque puede haber mas):
En la vida cotidiana
La corriente eléctrica que suministra energía a nuestros hogares está originada por electrones en movimiento. El tubo de rayos catódicos de un televisor se basa en un haz de electrones en el vacío desviado mediante campos magnéticos que impacta en una pantalla fluorescente. Los semiconductores utilizados en dispositivos tales como los transistores
En la industria y el laboratorio
En la industria:
El microscopio electrónico, que utiliza haces de electrones en lugar de fotones, permite ampliar hasta 500.000 veces los objetos. Los efectos cuánticos del electrón son la base del microscopio de efecto túnel, que permite estudiar la materia a escala atómica. Los haces de electrones se utilizan en soldaduras.
Doy una imagen de electrones girando orbitalmente alrededor del nucleo. Es un atomo de potasio:
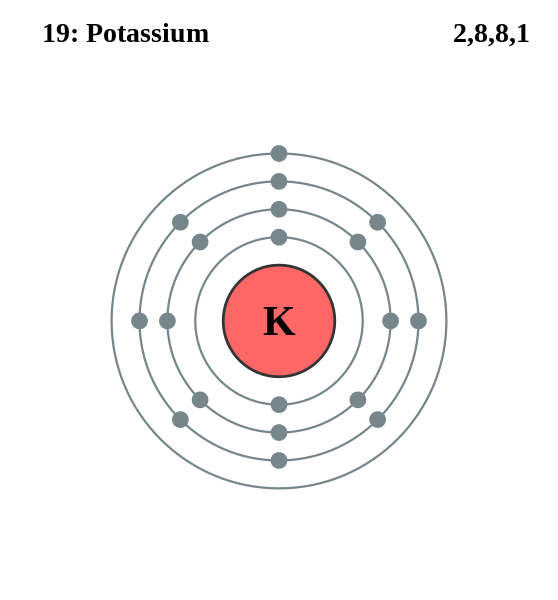
El numero de electrones seria la punta de las orbitas, las orbitas son para representar el trayecto de los electrones.

Proton
En física, el protón es una partícula subatómica con una carga eléctrica elemental positiva, es el equivalente a 1.836 veces la masa de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse; es decir, que sus partículas pierdan la consistencia que poseen y como tal el átomo. El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos.
El proton esta conformado por particulas subatomicas llamadas quarks (o como yo le digo "esta conformado por avena quacker"

 , el neutron tambien esta conformado por quarks. Generalmente se le acredita a Ernest Rutherford el descubrimiento del protón. En el año 1918 Rutherford encontró que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo muestran los signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de hidrógeno. Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental. Esto es decir cuando el nucleo tiene 1 proton, su numero atomico es 1 (hidrogeno).
, el neutron tambien esta conformado por quarks. Generalmente se le acredita a Ernest Rutherford el descubrimiento del protón. En el año 1918 Rutherford encontró que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo muestran los signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de hidrógeno. Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental. Esto es decir cuando el nucleo tiene 1 proton, su numero atomico es 1 (hidrogeno). Antiproton: El antiprotón es la antipartícula del protón. Se conoce también como protón negativo. Se diferencia del protón en que su carga es negativa y en que no forma parte de los núcleos atómicos. El antiprotón es estable en el vacío y no se desintegra espontáneamente. Sin embargo, cuando un antiprotón colisiona con un protón, ambas partículas se transforman en mesones, cuya vida media es extremadamente breve (véase Radiactividad). Si bien la existencia de esta partícula elemental se postuló por primera vez en la década de 1930, el antiprotón no se identificó hasta 1955, en el Laboratorio de Radiación de la Universidad de California, por Emilio Segre y Owen Chamberlain, razón por la cual les fue concedido el Premio Nobel de Física en 1959.
Proton conformado por quarks:
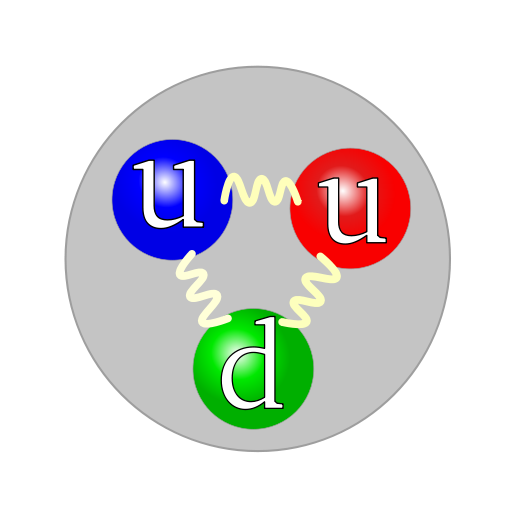
Creo que es un atomo de Helio:

Neutron
Un neutrón es un barión neutro formado por dos quarks abajo y un quark arriba. Forma, junto con los protones, los núcleos atómicos. Fuera del núcleo atómico es inestable y tiene una vida media de unos 15 minutos emitiendo un electrón y un antineutrino para convertirse en un protón. Su masa es muy similar a la del protón.
El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos (la única excepción es el hidrógeno), ya que interactúa fuertemente atrayéndose con los protones, pero sin repulsión electrostática. Con esto se dice que el neutron es como una especie de pegamento que enlazan todos los protones, creando estabilidad. Si no existiera este "pegamento" no se que pasaria con el atomo, pero estoy seguro que se autodestruiria o no se que.
Ernest Rutherford propuso por primera vez la existencia del neutrón en 1920, para tratar de explicar que los núcleos no se desintegrasen por la repulsión electromagnética de los protones.Finalmente (a finales de 1932) el físico inglés James Chadwick, en Inglaterra, realizó una serie de experimentos de los que obtuvo unos resultados que no concordaban con los que predecían las fórmulas físicas: la energía producida por la radiación era muy superior y en los choques no se conservaba el momento. Para explicar tales resultados, era necesario optar por una de las siguientes hipótesis: o bien se aceptaba la no conservación del momento en las colisiones o se afirmaba la naturaleza corpuscular de la radiación. Como la primera hipótesis contradecía las leyes de la física, se optó por la segunda. Con ésta, los resultados obtenidos quedaban explicados pero era necesario aceptar que las partículas que formaban la radiación no tenían carga eléctrica. Tales partículas tenían una masa muy semejante a la del protón, pero sin carga eléctrica, por lo que se pensó que eran el resultado de la unión de un protón y un electrón formando una especie de dipolo eléctrico. Posteriores experimentos descartaron la idea del dipolo y se conoció la naturaleza de los neutrones.Los neutrones son fundamentales en las reacciones nucleares: una reacción en cadena se produce cuando un neutrón causa la fisión de un átomo fisible, produciéndose un mayor número de neutrones que causan a su vez otras fisiones. Según esta reacción se produzca de forma controlada o incontrolada se tiene lo siguiente:
* Reacción incontrolada: sólo se produce cuando se tiene una cantidad suficiente de combustible nuclear -masa crítica-; fundamento de la bomba nuclear.
* Reacción controlada: mediante el uso de un moderador en el reactor nuclear; fundamento del aprovechamiento de la energía nuclear.


Suscribirse a:
Comentarios (Atom)















